近日,我校生物工程学院全舒团队联合清华大学薛毅团队与国家蛋白质科学研究(上海)设施吴斌博士,在分子伴侣蛋白的作用机制解析方面取得了重要进展,相关成果以“Insights into the client protein release mechanism of the ATP-independent chaperone Spy”为题发表在《自然-通讯》上(He et al., Nat Commun, 2022, 13(1):2818, doi: 10.1038/s41467-022-30499-x)。文章首次从动力学与结构层面对分子伴侣Spy的底物释放作用机制进行了解析。
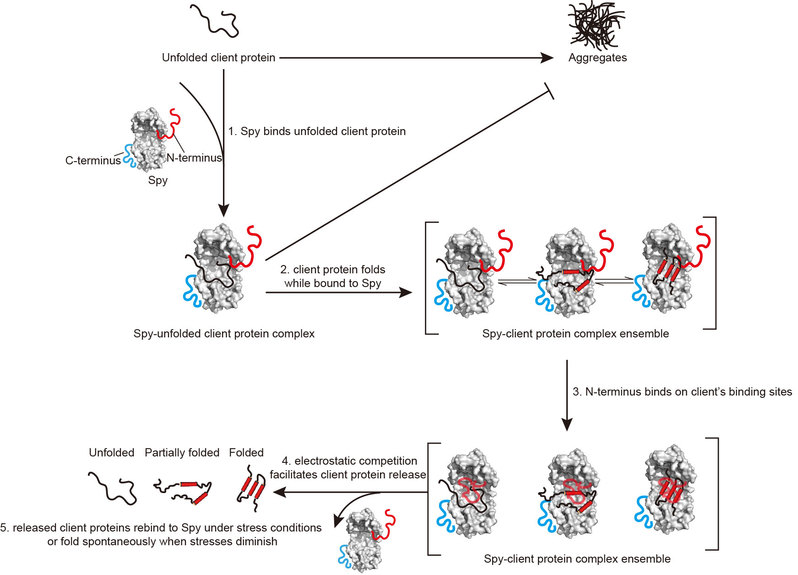
图片说明:分子伴侣Spy的工作机制
蛋白质错误折叠与聚集沉淀与多种人类疾病密切相关。分子伴侣是帮助蛋白正确折叠、抑制蛋白聚集沉淀、介导错误折叠蛋白降解的重要因子。掌握分子伴侣的作用机制,对于以分子伴侣为基础的新型疾病治疗手段的开发与优化具有至关重要的作用。分子伴侣Spy是一种较为原始的折叠型分子伴侣。我校生物工程学院全舒教授于2011年首次确立了Spy的分子伴侣功能并解析了其晶体结构(Quan et al.,Nat Struct Mol Biol, 2011, 18(3):262-269),又在2014年以Spy为研究对象阐明了分子伴侣的结构灵活性与分子伴侣活性的相关性(Quan, et al., eLife, 2014, 3:e01584)。随后,全舒团队在2020年与2021年又分别对Spy的抗聚集沉淀机制与生理底物进行了解析与鉴定(He et al., J Biol Chem, 2020, 295(42):14488-14500, He et al., mBio, 2021, 12(5):e0213021)。但至今为止,目前人们仍不清楚分子伴侣Spy如何不消耗能量而释放底物蛋白。
研究人员结合生物膜层反射光干涉、核磁共振及分子动力学模拟等手段研究发现,分子伴侣Spy的N末端无序区域(1-28位氨基酸残基区域)能够动态性地同Spy的底物结合表面进行分子内相互作用,这会造成与底物蛋白的竞争,从而促进底物蛋白从Spy表面释放。该工作不但拓展了分子伴侣内在无序区域的功能,也回答了困惑领域内多年的ATP非依赖型分子伴侣如何不借助外界能量输入和明显构象变化而完成工作循环的问题。同时,Spy特殊的底物释放分子机制也将为合成生物学中的人工分子伴侣元件的设计与开发提供重要理论参考。
我校生物工程学院何为博士、清华大学生命科学学院博士研究生黎欣明为本文共同第一作者,我校生物工程学院全舒教授、清华大学生命科学学院薛毅教授、张江实验室国家蛋白质科学研究(上海)设施吴斌博士为本文共同通讯作者,我校生物反应器工程国家重点实验室和生物工程学院是本文的第一通讯单位。研究得到了我校生物工程学院许建和教授的大力支持。研究获得了国家自然科学基金委、北京市结构生物学高精尖创新中心和清华-北大生命科学联合中心、上海市细胞代谢光遗传学技术前沿科学研究基地的经费支持。
原文链接:https://www.nature.com/articles/s41467-022-30499-x


